สารละลาย (solution) หมายถึง สารที่ประกอบด้วยอนุภาคของสารบริสุทธิ์ (ธาตุหรือสารประกอบ) ตั้งแต่ 2 ชนิดขึ้นไป ละลายเป็นเนื้อเดียวกัน แบ่งเป็น 2 ส่วน คือ ตัวทำลาย และตัวถูกทำลาย โดยตัวถูกละลายจะมีสัดส่วนจำกัดในระดับใดระดับหนึ่ง หากมีสัดส่วนมากเกินพอจะเกิดการตกผลึกกลายเป็นของแข็ง ทั้งนี้ สารละลายจะมีอัตราส่วนการรวมตัวของตัวทำลาย และตัวถูกทำลายที่ไม่คงที่ ทำให้สารละลายมีจุดเดือด และจุดหลอมเหลวไม่คงที่ตามมา
องค์ประกอบของสารละลาย
1. ตัวทำละลาย (Solvent)
ตัวทำละลาย คือ สารที่ให้อนุภาคของสารอื่นสามารถแทรกกระจายตัวอยู่ได้ และเป็นสารที่มีปริมาตรมากกว่าตัวถูกละลาย ซึ่งเป็นได้ทั้งของแข็ง ของเหลว และก๊าซ แต่ที่พบ และถูกใช้ประโยชน์มากจะเป็นของเหลว โดยเฉพาะน้ำสำหรับทำละลาย และของแข็งจากการทำโลหะผสม
โดยทั่วไป ตัวทำละลายที่ประยุกต์ใช้ในทางอุตสาหกรรมหรือนำมาใช้ประโยชน์ จะต้องไม่ทำปฏิกิริยากับตัวถูกละลายเป็นสำคัญ เพราะหากตัวทำปฏิกิริยากับตัวถูกละลายจะทำให้ตัวถูกละลายเปลี่ยนเป็นสารอื่นหรือเสื่อมสภาพไป ไม่เกิดประโยชน์จากตัวถูกละลายในสารละลาย แต่อาจมีประโยชน์จากสารอื่นที่เกิดจากการทำปฏิกิริยา นอกจากนั้น ตัวทำละลายควรเป็นสารที่แยกสกัดออกจากตัวถูกละลายได้ง่าย โดยเฉพาะตัวทำละลายสำหรับการสกัดสารออกจากพืชหรือวัสดุ เช่น การสกัดสารสำคัญจากสมุนไพร
2. ตัวถูกละลาย (Solute)
ตัวถูกละลาย เป็นได้ทั้งของแข็ง ของเหลว และก๊าซ ที่ละลายกระจายตัวอยู่ได้ทั้งในสารทั้ง 3 ชนิด แต่ตัวถูกละลายมีขนาดอนุภาคเล็กกว่า 10-7 เซนติเมตร หรือเล็กกว่า 0.001 ไมครอน จึงสามารถกระจายตัวแทรกอยู่กับตัวทำละลายเป็นเนื้อเดียวกันอย่างสมบูรณ์ ทั้งนี้ สารละลายไม่สามารถแยกออกจากตัวทำละลายด้วยวิธีตกตะกอน และการกรองกรอง แต่สามารถแยกออกจากตัวทำละลายได้ในวิธีต่างๆ ได้แก่ การกลั่น โครมาโทกราฟี และการให้ความร้อนหรือการตกผลึก เป็นต้น เช่น น้ำหวานที่ได้จากการละลายน้ำตาลทรายในน้ำ เมื่อนำน้ำหวานมาให้ความร้อนจนตัวทำละลาย คือ น้ำ ระเหยจนหมดจะคงเหลือผลึกของน้ำตาลทราย ซึ่งการตกผลึกจะเริ่มเมื่อสารละลายน้ำตาลทรายมีความเข้มข้นถึงจุดวิกฤตที่จะละลายในน้ำได้ เพราะความเข้มข้นของน้ำตาลทรายจะเพิ่มขึ้น ขณะที่น้ำมีปริมาณน้อยลงจากการระเหยอย่างต่อเนื่อง

ชนิดของสารละลาย
1. แบ่งตามสถานะสารละลาย
– สารละลายสถานะของแข็ง เช่น ทองเหลือง ที่ได้จากการละลายสังกะสีในทองแดง (ทองแดง + สังกะสี) ซึ่งจะใช้ทองแดงมากว่าร้อยละ 50 ขึ้นไป
– สารละลายสถานะของเหลว เช่น น้ำเกลือ ที่ได้จากนำเกลือ (NaCl) มาละลายน้ำ เป็นต้น
– สารละลายสถานะก๊าซ เช่น อากาศ และก๊าซต่าง ๆ
2. แบ่งตามสถานะตัวทำละลาย และสถานะตัวถูกละลาย
| ลำดับ | ตัวทำละลาย | ตัวถูกละลาย | สารละลาย | ตัวอย่าง |
| 1 | ก๊าซ | ก๊าซ | ก๊าซ | อากาศ หรือ ก๊าซผสมต่างๆ |
| 2 | ก๊าซ | ของเหลว | ก๊าซ | ไอน้ำในอากาศ |
| 3 | ก๊าซ | ของแข็ง | ก๊าซ | ลูกเหม็นระเหยในอากาศ |
| 4 | ของเหลว | ก๊าซ | ของเหลว | ก๊าซละลายในน้ำ เช่น น้ำโซดา |
| 5 | ของเหลว | ของเหลว | ของเหลว | สุราที่มีแอลกอฮอล์ในน้ำ |
| 6 | ของเหลว | ของแข็ง | ของเหลว | น้ำตาลทรายในน้ำ หรือ น้ำเชื่อม |
| 7 | ของแข็ง | ก๊าซ | ของแข็ง | ก๊าซไฮโดรเจนในโลหะแพลตินัม |
| 8 | ของแข็ง | ของเหลว | ของแข็ง | ปรอทในเงิน (เงินอะมัลกัม) |
| 9 | ของแข็ง | ของแข็ง | ของแข็ง | นาก (ทองคำละลายในทองแดง) |
3. ใช้การอิ่มตัวของสารละลาย
– สารละลายอิ่มตัว (Saturated Solution ) หมายถึง สารละลายที่มีตัวถูกละลาย ละลายอยู่อย่างเข้มข้นจนไม่สามารถละลายได้ต่อไปอีกในอุณหภูมิปกติ แต่หากเพิ่มอุณหภูมิให้สูงขึ้นจะสามารถละลายได้เพิ่มขึ้น และจะไม่ละลายได้อีกเมื่อถึงระดับอุณหภูมิหนึ่งๆ และสารละลายบางชนิด เมื่อปล่อยให้เย็นตัวลง ตัวถูกละลายบางส่วนจะตกผลึกตกลงด้านล่าง ทั้งนี้ สารละลายแต่ละชนิดจะมีจุดอิ่มตัวของการละลายที่แตกต่างกัน
– สารละลายไม่อิ่มตัว (Unsaturated Solution) หมายถึง สารละลายที่มีตัวถูกละลาย ละลายอยู่อย่างเจือจางหรือสามารถละลายได้ต่อไปอีกแม้อยู่ในอุณหภูมิปกติ
การแยกแยะตัวทำละลาย และตัวถูกละลายในสารละลาย
สารละลาย เมื่อมองผ่านสารละลายจะพบว่าสารกลายเป็นเนื้อเดียวกันอย่างสมบูรณ์ ทำให้แยกแยะได้ยากว่าสารใดเป็นตัวทำละลายหรือถูกละลาย แต่มีวิธีแยกแยะ ดังนี้
1. ตัวทำละลาย และตัวถูกละลายมีสถานะเดียวกัน
กรณีนี้ จะใช้หลักการแยกแยะ คือ สารใดที่มีปริมาณมากที่สุดจะเป็นตัวทำละลาย ส่วนสารที่มีปริมาณน้อยกว่าจะเป็นตัวถูกละลาย เช่น
– สารละลายแอลกอฮอล์สำหรับฆ่าเชื้อโรค ประกอบด้วยเอทานอล (C2H5OH) 70% ถือเป็นตัวทำละลาย และน้ำ 30% ถือเป็นตัวถูกละลาย
– ฟิวส์ไฟฟ้า ประกอบด้วยบิสมัส (Bi) ประมาณ 50 % ถือเป็นตัวทำละลาย ส่วนตะกั่ว (Pb) ประมาณ 25% และดีบุก (Sn) ประมาณ 25% ถือเป็นตัวถูกละลายทั้งคู่
2. ตัวทำละลาย และตัวถูกละลายมีสถานะต่างกัน
กรณีนี้ ใช้หลักการแยกแยะ คือ สารละลายมีสถานะใด ตัวทำละลายจะมีสถานะนั้นเช่นกัน เช่น น้ำเชื่อม (น้ำ + น้ำตาลทราย) มีสถานะเป็นของเหลว ดังนั้น ตัวทะละลายย่อมมีสถานะเป็นของเหลวเช่นกัน คือ น้ำ ส่วนตัวถูกละลาย คือ น้ำตาลทราย
คุณสมบัติของสารละลาย
1. การละลาย
การละลายของของแข็งในของเหลวสามารถสังเกตการณ์เปลี่ยนแปลงได้ด้วยสายตา อาทิ การละลายด่างทับทิมในน้ำ เมื่อก้อนด่างทับทิมเริ่มละลายจะมองเห็นสารสีม่วงแผ่กระจายออกเรื่อย พร้อมกับปริมาตรของก้อนด่างทับทิมจะน้อยลงจนละลายหมด
2. เกิดปฏิกิริยาดูดหรือคายความร้อน
เมื่อตัวถูกละลายเริ่มละลาย อาจเกิดปฏิกิริยาดูดความร้อนขึ้น เพราะอุณหภูมิในระบบต่ำกว่าสิ่งแวดล้อมภายนอก เช่น การละลายเกลือแกงที่เกิดปฏิกิริยาดูดความร้อน สังเกตได้จากใช้มือสัมผัสภาชนะจะรู้สึกเย็นลง หรืออาจเกิดเกิดปฏิกิริยาคายความร้อน เพราะอุณหภูมิในระบบสูงกว่าสิ่งแวดล้อมภายนอก เช่น การละลายผงซักฟอก ซึ่งเมือจับผงวักฟอกละลายน้ำหรือจับภาชนะจะรู้สึกร้อนขึ้น
3. เป็นสารเนื้อเดียวกัน
สารละลายทุกชนิดไม่แยกชั้น เนื้อสารรวมเป็นเนื้อหรือสีเดียวกันได้อย่างสมบูรณ์ มีองค์ประกอบ และคุณสมบัติภายในเหมือนกัน
4. จุดเดือด และจุดหลอมเหลวไม่คงที่
สารละลายจะมีอัตราส่วนการรวมตัวของตัวทำลาย และตัวถูกทำลายที่ไม่คงที่
5. ไม่เกิดปรากฏการณ์ทินดอลล์
สารละลายมีขนาดโมเลกุลที่เล็กกว่าอนุภาคคอลลอยด์มาก และอนุภาครวมเป็นเนื้อเดียวกันได้อย่างสมบูรณ์ ไม่แยกเป็นชั้นหรือแขวนลอย เมื่อลำแสงวิ่งผ่านจึงไม่เกิดการสะท้อนของลำแสงเข้าสู่ตาเรา
6. การตกผลึก
สารละลายอิ่มตัวในสภาวะถูกเพิ่มอุณหภูมิ เมื่ออุณหภูมิเย็นลงจนถึงอุณหภูมิปกติ ตัวถูกละลายบางส่วนจะไม่สามารถคงสภาพการเป็นสารละลายได้ จนเกิดการตกผลึกเป็นของแข็งลงสู่ด้านล่าง
ความเข้มข้นของสารละลาย
ความเข้มข้นของสารละลาย หมายถึง สัดส่วนของตัวถูกละลายที่ละลายอยู่ในสารละลาย แบ่งได้เป็น
1. ร้อยละโดยมวลต่อมวล (w/w)
ร้อยละโดยมวลต่อมวล หรือ น้ำหนักต่อน้ำหนัก หมายถึง สัดส่วนเป็นร้อยละของมวลตัวถูกละลายต่อมวลสารละลาย เช่น สารละลายเกลือแกง ความเข้มข้น 10% w/w หมายความว่า ในสารละลายเกลือแกงทั้งหมด 1,000 กรัม จะมีตัวทำละลาย (น้ำ) 900 กรัม และมีเกลือแกง ละลายอยู่ 100 กรัม
% w/w = น้ำหนักตัวถูกละลาย x 100
********น้ำหนักสารละลาย
2. ร้อยละโดยมวลต่อปริมาตร (w/v)
ร้อยละโดยมวลต่อปริมาตร หรือ ร้อยละโดยน้ำหนักต่อปริมาตร หมายถึง สัดส่วนเป็นร้อยละของมวลตัวถูกละลายต่อปริมาตรสารละลาย เช่น สารละลายเกลือแกง ความเข้มข้น 10% w/v หมายความว่า ในสารละลายเกลือแกงทั้งหมด 1,000 ลูกบาศก์เซนติเมตร จะมีตัวทำละลาย (น้ำ) 900 ลูกบาศก์เซนติเมตร และมีเกลือแกง ละลายอยู่ 100 กรัม
% w/v = น้ำหนักตัวถูกละลาย x 100
********ปริมาตรสารละลาย
3. ร้อยละโดยปริมาตรต่อปริมาตร (v/v)
ร้อยละโดยปริมาตรต่อปริมาตร หมายถึง สัดส่วนเป็นร้อยละของปริมาตรตัวถูกละลายต่อปริมาตรสารละลาย เช่น สารละลายเกลือแกง ความเข้มข้น 10% v/v หมายความว่า ในสารละลายเกลือแกงทั้งหมด 1,000 ลูกบาศก์เซนติเมตร จะมีตัวทำละลาย (น้ำ) 900 ลูกบาศก์เซนติเมตร และมีเกลือแกง ละลายอยู่ 100 ลูกบาศก์เซนติเมตร
% v/v = ปริมาตรตัวถูกละลาย x 100
*******ปริมาตรสารละลาย
ปัจจัยที่มีผลต่อการละลายของสาร
1. ชนิดของสาร
ชนิดของสารมีผลต่อการละลาย สารที่มีโมเลกุลใหญ่จะละลายได้ช้ากว่าสารที่มีโมเลกุลเล็ก
2. อุณหภูมิ
อุณหภูมิมีผลโดยตรงต่อการละลายของสาร โดยสารส่วนมาก เมื่ออุณหภูมิเพิ่มขึ้น การละลายย่อมเพิ่มขึ้น แต่จะคงที่ที่ระดับอุณหภูมิหนึ่งๆ ซึ่งแตกต่างกันในแต่ละสาร แต่สารบางชนิดอาจละลายได้น้อยลงเมื่ออุณหภูมิเพิ่มขึ้น โดยเฉพาะการละลายก๊าซในตัวกลางต่างๆ
3. ความดัน
ความดันมีผลต่อการละลายของสารในทางอ้อม กล่าวคือ ความดันมีผลโดยตรงต่ออุณหภูมิ คือ ความดันเพิ่มขึ้นจะทำให้อุณหภูมิเพิ่มขึ้น หากความดันลดลง อุณหภูมิจะลดลงเช่นกัน และความดันมีผลต่อการละลายได้โดยตรงเช่นกัน กล่าวคือ เมื่อความดันเพิ่มขึ้น การละลายของสารในตัวทำละลายจะเพิ่มขึ้น เช่น การอัดก๊าซคาร์บอนไดออกไซด์ลงในน้ำ (น้ำโซดา) หากอัดด้วยความดันสูงจะทำให้ก๊าซละลายลงในน้ำได้ดี พร้อมกับปิดขวดทันทีเพื่อรักษาความดันให้คงที่ แต่เมื่อความดันลดลง เช่น เมื่อเปิดฝาขวดโซดา ก๊าซคาร์บอนไดออกไซด์จะระเหยออกมาได้ง่าย
วิธีการแยกสารละลาย
1. การกลั่น
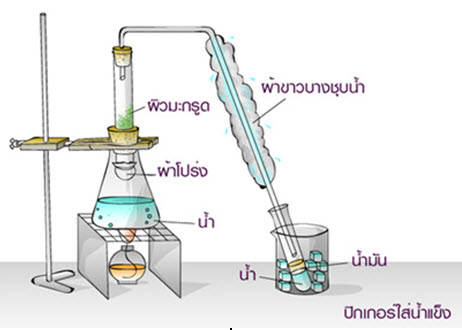
การกลั่น เป็นวิธีการแยกตัวทำละลาย และตัวถูกละลายออกจากสารละลายที่มีสถานะเป็นของเหลว โดยอาศัยหลักการที่ว่า ตัวทำละลาย และตัวถูกละลายในสารละลายของเหลวจะมีจุดเดือดแตกต่างกัน เช่นน้ำมันหอมระเหยที่รวมเป็นสารละลายจากการสกัดสมุนไพร เมื่อนำมากลั่น น้ำมันหอมระเหยจะระเหยออกมาเป็นไอ ก่อนสัมผัสกับความเย็นกลั่นตัวได้น้ำมันหอมรเหยออกมา
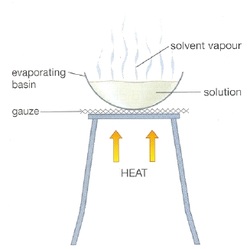
2. การระเหย และการตกผลึก
การระเหย และการตกผลึก มีหลักการคล้ายกับการกลั่น คือ สารในสารละลายมีจุดเดือดต่างกัน แต่การตกผลึกจะใช้วิธีให้ความร้อนจนตัวทำละลายระเหยออกจนหมดหรือเหลือน้อยที่สุด ให้คงเหลือเฉพาะตัวถูกละลายหรือให้ตัวถูกละลายมีความเข้มข้นสูงเกินพอที่จะตกผลึกเป็นของแข็ง เช่น การระเหยน้ำออกจากน้ำเกลือ จนสารละลายเกลือเข้มข้นจนถึงจนอิ่มตัวของเกลือ แล้วเกิดการตกผลึกเกลืออยู่ด้านล่าง แต่หากให้ความร้อนต่อจนน้ำระเหยออกจนหมด ก็จะคงเหลือผลึกเกลือเพียงอย่างเดียว
3. การสกัดด้วยตัวทำละลาย
การสกัดด้วยตัวทำละลาย เป็นวิธีที่นิยมใช้แยกของแข็งหรือของเหลวออกมาจากสารอื่นให้ละลายในตัวทำละลาย เช่น การสกัดสารสีหรือน้ำมันหอมระเหยในสมุนไพรด้วยการต้มน้ำหรือละลายด้วยแอลกอฮอล์ โดยตัวทำละลายต้องมีคุณสมบัติ ดังนี้
– สามารถละลายสารที่ต้องการสกัดได้ดี
– ไม่ละลายสารอื่นหรือละลายสารอื่นที่ไม่ต้องการสกัด
– ไม่ทำปฏิกิริยากับสารที่ต้องการสกัด
– สามารถแยกออกจากสารที่สกัดได้ง่าย
– ไม่เป็นพิษ และมีราคาถูก
การสกัดด้วยตัวทำละลายอาจใช้ความร้อนเข้าช่วยในการทำละลาย เมื่อละลายสารสกัดได้แล้วจึงนำสารละลายมาเข้าสู่กระบวนการแยกสารให้บริสุทธิ์ต่อ วิธีที่นิยมมาก คือ การกลั่น ได้แก่ การกลั่นด้วยไอน้ำ หรือการกลั่นลำดับส่วน
4. โครมาโทกราฟี
โครมาโทกราฟี เป็นเทคนิคพิเศษที่สามารถแยกตัวถูกละลายที่มีหลายชนิดออกจากกันได้ ซึ่งเหมาะสำหรับแยกสารผสมที่มีความเข้มข้นน้อยให้เป็นสารบริสุทธิ์
ระบบโครมาโทกราฟี ประกอบด้วยตัวดูดซับทำหน้าที่ในการแยกสารออกจากสารละลายเป็นหลัก ตัวดูดซับที่นิยมใช้ ได้แก่ กระดาษโครมาโทกราฟี ซิลิกาเจล และอลูมินา
การทำงานของโครมาโทกราฟี คือ เริ่มแรก สารตัวทำละลายจะถูกดูดซับก่อน จากนั้น สารตัวถูกละลายจะถูกดูดซับตามมา โดยตัวถูกละลายจะผ่านตัวดูดซับในความเร็วที่แตกต่างกัน สารที่ดูดซับได้เร็วจะเคลื่อนที่ผ่านตัวดูดซับได้เร็ว และดูดซับได้หมดก่อน ส่วนสารที่ดูดซับได้ช้า จะเคลื่อนที่ช้า และถูกดูดซับได้หมดช้ากว่า ซึ่งจะเกิดการแบ่งเป็นชั้นๆของแต่ละสารบนตัวดูดซับ
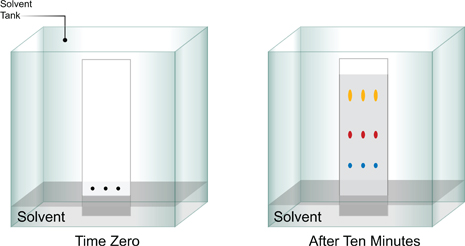
ระบบโครมาโทกราฟี ได้แก่
– โครมาโทกราฟีแบบคอลัมน์ ประกอบด้วยตัวดูดซับ เช่น อะลูมินา หรือ ซิลิกาเจล บรรจุอยู่ในคอลัมน์แก้ว
– โครมาโทกราฟีแบบกระดาษ ประกอบด้วยกระดาษโครมาโทกราฟีหรือกระดาษกรองเป็นหลัก
– โครมาโทกราฟีแบบธินเลเยอร์ ประกอบด้วยกระจกที่ฉาบด้วยอะลูมินาหรือซิลิกาเจล สารที่ฉาบนี้ ทำหน้าที่เป็นตัวดูดซับคล้ายกระดาษกรอง
ข้อจำกัดของระบบโครมาโทกราฟี คือ ตัวถูกละลายที่เคลื่อนที่ผ่านตัวดูดซับได้เท่ากันหรือใกล้เคียงกัน จะทำให้แยกสารแต่ละชนิดออกจากกันไม่ได้หรือแยกได้ แต่ไม่บริสุทธิ์

