การดุลสมการเคมี หมายถึง การหาจำนวนอะตอมของธาตุหรือสารแต่ละชนิดให้เกิดความสมดุลระหว่างสารตั้งต้น และสารผลิตภัณฑ์ตามหลักการของกฎทรงมวล
การดุลสมการเคมี มีความเกี่ยวข้องกับปฏิกิริยาเคมี 2 แบบ ได้แก่
1. ปฏิกิริยาอย่าง่าย
ปฏิกิริยานี้ ธาตุที่เกี่ยวข้องจะไม่มีการเปลี่ยนแปลงของเลขอะตอม จึงใช้วิธีดุลสมการแบบตรวจพินิจเลขอะตอมได้โดยตรง
2. ปฏิกิริยารีดอกซ์
ปฏิกิริยานี้ ธาตุที่เกี่ยวข้องมีการเปลี่ยนแปลงของอะตอม จึงใช้วิธีดุลสมการแบบพิจารณาอะตอมหรือใช้วิธีพิจารณาครึ่งเซลล์หรืออิออน อย่างใดอย่างหนึ่งก็ได้
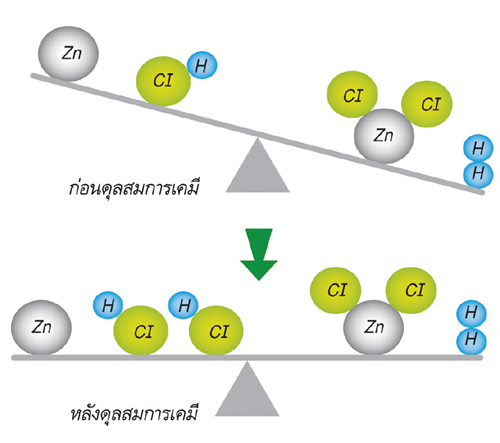
วิธีดุลสมการเคมีอย่างง่าย
วิธีดุลสมการข้างต้นทั้ง 2 ปฏิกิริยาจะไม่ขอกล่าวในทีนี้ แต่ขอนำเสนอวิธีดุลสมการเคมีอย่างง่ายที่สามารถใช้ดุลสมการของทั้ง 2 ปฏิกิริยาได้ โดยเริ่มจากปฏิกิริยาอย่างง่าย ดังนี้
CH4 + xO2 → CO2 + 2H2O (สมการที่ 1)
จากสมการข้างต้น สามารถให้สัมประสิทธิ์ของ CH4 เป็น 1 (โมเลกุลของ CH4) จากนั้น หาค่า x ได้ด้วยกฎทรงมวล ซึ่งหมายความว่า ในสมการของปฏิกิริยาใดๆ จำนวนอะตอมของธาตุแต่ละธาตุของแต่ละข้างสมการจะต้องเท่ากัน ฉะนั้น เมื่อแก้สมการย่อยของเลขออกซิเจนที่ได้ดุลแล้ว ก็จะได้ค่า x ดังนี้
สมการ O : 2x = 2 + 2 (สมการที่ 2)
ดังนั้น x = 2
2x มาจาก xO2 โดยค่า 2 หมายถึง เลขอะตอมของ O ที่เป็น 2
2 + 2 มาจาก 2x มาจาก CO2 + 2H2O โดยค่า 2 ของตัวแรก มาจาก CO2 ซึ่ง O มีเลขอะตอมเป็น 2 และค่า 2 ของตัวที่สองมาจาก 2H2O ซึ่ง O มีเลขอะตอมเป็น 2
จากการดุลสมการของปฏิกิริยาประเภทนี้ จะพบว่า ตัวแปรที่ต้องมีการดุล จะมีมากกว่าจำนวนสมการที่ดุลเป็น 1 เสมอ กล่าวคือ ในสมการที่ 1 มีตัวแปรที่เกี่ยวข้องอยู่ 2 ตัว คือ CH4 และ O2 ทั้งนี้ โดยทั่วไปจะนิยมกำหนดค่าตัวแปรตัวใดตัวหนึ่งตามใจชอบ เพื่อให้สัมประสิทธิ์ที่ได้ทั้งชุดเป็นเลขจำนวนเต็มที่มีค่าน้อยที่สุด
กรณีที่ตัวแปรมีจำนวน 1 ตัว เท่ากับจำนวนสมการ เช่น ปฏิกิริยาของกรดซัลฟูริคสูญเสียน้ำ
H2SO4 → H2O + SO3 (สมการที่ 3)
จากสมการข้างต้นพบว่า มีธาตุ 3 ชนิด คือ H, S และO แต่ละตัวมีค่าสัมประสิทธิ์เท่ากับ 1 และหากกำหนดให้จำนวนอะตอมของกำมะถัน (S) ทางด้านซ้ายมือเป็น 1 ก็จะพบว่า ซัลเฟอร์ไตรออกไซด์ (SO3) ก็จะมีเพียง 1 โมเลกุลด้วย ฉะนั้น น้ำ (H2O) ก็จะต้องมีเพียง 1 โมเลกุลด้วย จึงจะทำให้โมเลกุลของไฮโดรเจน (H) ในน้ำ (H2O) กับกรดซัลฟูริค (H2SO4) มีค่าเท่ากัน และเมื่อพิจารณาจำนวนอะตอมของออกซิเจน ก็พบว่ามีความสมดุลแล้วเช่นกัน
แต่หากเป็นปฏิกิริยาที่มีเลขอะตอมเปลี่ยนไป เช่น
H2SO4 → H2O + SO2 (สมการที่ 4)
ให้กำหนดเลขสัมประสิทธิ์ของ H2SO4 เป็น x (xH2SO4) และค่าตัวแปรของน้ำ (H2O) กับซัลเฟอร์ไดออกไซด์ (SO2) เป็น x ก็จะได้สมการ
xH2SO4 → xH2O + xSO2 (สมการที่ 5)
เมื่อพิจารณาสมการของออกซิเจนจะพบว่า
สมการ O : 4x = x + 2x (สมการที่ 6)
ซึ่งสมการจะเป็นจริงก็ต่อเมื่อ x = 0 ดังนั้น สมการที่ 4 จึงไม่สามารถเป็นไปได้
การดุลสมการรีดอกซ์ด้วยวิธีนี้ก็สามารถทำได้ง่ายเช่นกัน ดังตัวอย่างปฏิกิริยาของกรดไนตริกออกซิไดซ์โลหะทองแดงในสมการที่ 7
Cu + HNO3 → Cu(NO3)2 + NO + H2O (สมการที่ 7)
ให้ลองกำหนดอะตอมของทองแดงเป็น 1 และจำนวนโมเลกุลของกรดไนตริกเป็น b และโมเลกุลที่ประกอบด้วยไฮโดรเจนมีเพียงข้างละ 1 สาร ดังนั้น จึงเขียนสมการใหม่ได้ดังนี้
Cu + bHNO3 → Cu(NO3)2 + dNO + b/2H2O (สมการที่ 8)
ดังนั้น การตั้งดุลสมการของไนโตรเจน และออกซิเจนจะเป็น
สมการ N : b = 2 + d (สมการที่ 9)
สมการ O : 3b = 6 + d + b/2 (สมการที่ 10)
จากสมการที่ 9 และ 10 ก็จะได้ค่า b = 8/3 และ d = 2/3 ครั้นเมื่อปรับเลขสัมประสิทธิ์ (b และ d) ให้เป็นเลขจำนวนเต็ม ก็จะได้สมการเคมีที่ดุลสมบูรณ์ ดังสมการที่ 11
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (สมการที่ 11)
สมการรีดอกซ์แบบไอออนิคดังแสดงในสมการที่ 12 ก็ดุลได้ง่ายเช่นกัน โดยกำหนดให้จำนวนอะตอมของโครเมียม (Cr) เป็น 1 ไว้ก่อน และกำหนดค่าตัวแปรให้ครบในแต่ละสารทั้งสองข้าง
Cr(OH)4– + aOH– + bH2O2 → CrO2-4 + cH2O (สมการที่ 12)
ดังนั้น การตั้งดุลสมการได้ ดังนี้
สมการ O : 4 + a + 2b = 4 + c (สมการที่ 13)
สมการ H : 4 + a + 2b = 2c (สมการที่ 14)
สมการของประจุ : -1 + (-a) = -2 (สมการที่ 15)
จากสมการที่ 15 ให้ค่า a = 1 จากสมการที่ 13 และ 14 ให้ค่า c = 4 และค่า b = 3/2 และเมื่อปรับค่าสัมประสิทธิ์ (a, b และc) ให้เป็นเลขจำนวนเต็ม ก็จะได้สมการที่ดุลสมบูรณ์ดังสมการที่ 16
2Cr(OH)4– + 2OH– + 3H2O2 → 2CrO2-4 + 8H2O (สมการที่ 16)
สมการที่มีสารอินทรีย์เกี่ยวข้องก็ดุลได้เช่นกัน โดยไม่ต้องกังวลถึงเลขออกซิเดชันของอะตอมคาร์บอน ดังจะเห็นได้ในสมการที่ 17 ที่แสดงปฏิกิริยาออกซิเดชันของกรดออกซาลิก (H2C2O4)
H2C2O4 + MnO4– + H3O+ → CO2 + Mn2+ + H2O (สมการที่ 17)
เมื่อกำหนดให้จำนวนโมเลกุลของกรดออกซาลิก (H2C2O4) เป็น 1 พร้อมกับกำหนดตัวแปรของค่าสัมประสิทธิ์ของสารอื่นในทั้งสองข้าง ได้สมการ ดังนี้
H2C2O4 + aMnO4– + bH3O+ → 2CO2 + aMn2+ + cH2O (สมการที่ 18)
จากสมการที่ 18 หากกำหนดโมเลกุลของกรดออกซาลิก (H2C2O4) เป็น 1 ดังนั้น โมเลกุลของ CO2 จึงต้องเป็น 2 และสามารถตั้งดุลสมการได้ ดังนี้
สมการ H : 2 + 3b = 2c (สมการที่ 19)
สมการ O : 4 + 4a + b = 4 + c (สมการที่ 20)
สมการของประจุ : -a + b = 2a (สมการที่ 21)
เมื่อแก้สมการที่ 19, 20 และ21 ก็จะได้ a = 2/5, b = 6/5 และ c = 14/5 และเมื่อปรับให้เป็นตัวเลขจำนวนเต็มก็จะได้สมการที่ดุลสมบูรณ์ ดังสมการที่ 22
5H2C2O4 + 2MnO4– + 6H3O+ → 10CO2 + 2Mn2+ + 14H2O (สมการที่ 22)
การดุลสมการข้างต้น จะสังเกตได้ว่า สามารถดุลสมการรีดอกซ์ได้โดยไม่ต้องอาศัยเลขออกซิเดชันก็ได้ วิธีเช่นนี้จึงสะดวกมาก และใช้ได้ดีกับสมการของปฏิกิริยาที่มีการเปลี่ยนแปลงเลขออกซิเดชันหลายค่า ดังสมการที่ 23
CrSCN2+ + Cl2 + H3O+ → 2Cl– + NO3– + CO2 + SO42- + Cr2O72- + H2O (สมการที่ 23)
ให้กำหนดเลขสัมประสิทธิ์ด้านหน้าของ CrSCN2+ เป็น 2 ไว้ก่อน เพราะ Cr มีเพียงอันเดียวที่ปรากฏด้านขวามือ คือ Cr2O72- พร้อมกับกำหนดตัวแปรให้แต่ละสารในทั้ง 2 ฝั่ง จนได้เป็นสมการที่ 24
2CrSCN2+ + aCl2 + bH3O+ → 2aCl– + 2NO3– + 2CO2 + 2SO42- + Cr2O72- + 3b/2H2O (สมการที่ 24)
จากสมการที่ 24 สามารถตั้งดุลสมการได้ ดังนี้
สมการ O : b = 6 + 4 + 8 + 7 + 3b/2 (สมการที่ 25)
สมการของประจุ : 4 + b = -2a – 2 – 4 – 2 (สมการที่ 26)
เมื่อแก้สมการที่ 25 โดยให้ b = -50 และนำไปแก้สมการที่ 26 จะได้ค่า a = 19 จากนั้น นำค่าทั้งสองแทนตัวแปรในสมการที่ 24 ก็จะได้ตามสมการที่ 27
2CrSCN2+ + 19Cl2 – 50H3O+ → 38Cl– + 2NO3– + 2CO2 + 2SO42- + Cr2O72- – 75H2O (สมการที่ 27)
เมื่อย้ายข้างของ H3O+ และ H2O ก็จะได้สมการที่ดุลสมบูรณ์ ดังนี้
2CrSCN2+ + 19Cl2 + 75H2O → 38Cl– + 2NO3– + 2CO2 + 2SO42- + Cr2O72- + 50H3O+ (สมการที่ 28)
นอกจากนั้น ยังมีสมการเคมีตัวอย่างอื่น เช่น ปฏิกิริยาของกรดไนตริกออกซิไดซ์โมลิบดีนัมซัลไฟด์ ซึ่งให้กำหนดค่าสัมประสิทธิ์ด้านหน้าของโมลิบดีนัมเป็น 1 ไว้ก่อน ตามสมการด้านล่าง
Mo4S7 + xH+ + yNO3– → 4MoO42- + yNO + 7S + x/2H2O (สมการที่ 29)
จากสมการที่ 29 สามารถตั้งดุลสมการได้ ดังนี้
สมการ O : 3y = 16 + y + x/2 (สมการที่ 30)
สมการของประจุ : x – y = -8 (สมการที่ 31)
เมื่อแก้สมการก็จะได้ x = 0 และ y = 8 นำค่าตัวแปรไปแทนค่าในสมการก็จะได้สมการที่ดุลสมบูรณ์ และเขียนเป็นสมการใหม่ได้ ดังนี้
Mo4S7 + 8NO3– → 4MoO42- + 8NO + 7S (สมการที่ 32)
จากตัวอย่างสมการที่ 29 จะเห็นได้ว่า H+ ไม่ใช่สารทำปฏิกิริยาโดยตรง แต่อาจเป็นเพียงคะตะลิสต์ที่ช่วยเร่งปฏิกิริยา ดังนั้น จึงไม่ต้องใส่ในสมการที่ 32 ก็ได้
ปฏิกิริยาไฟฟ้าเคมีที่ประกอบด้วยปฏิกิริยาออกซิเดชัน แยกจากปฏิกิริยารีดักชัน ก็สามารถดุลสมการได้ด้วยวิธีที่กล่าวมา ดังตัวอย่างปฏิกิริยาครึ่งเซลล์ของ Cr3+ ของสารละลายเบส ดังนี้
Cr(OH)4– + OH– → CrO42- + H2O + ne– (สมการที่ 33)
ให้กำหนดสัมประสิทธิ์ด้านหน้าของ Cr เป็น 1 และใส่ตัวแปรของสารอื่นจะได้สมการใหม่ ดังนี้
Cr(OH)4– + xOH– → CrO42- + (x+4)/2H2O + ne– (สมการที่ 34)
เมื่อตั้งสมการ และแก้สมการของ O และสมการของประจุจะได้ค่า r = 4 และ n = 3 และหากแทนค่าตัวแปรในสมการที่ 34 ก็จะได้สมการที่ดุลสมบูรณ์ ดังนี้
Cr(OH)4– + 4OH– → CrO42- + 4H2O + 3e– (สมการที่ 35)
อีกตัวอย่างสมการที่ปฏิกิริยามีโอกาสเกิดขึ้นในหลายแบบพร้อมๆกัน คือ
ClO2– + H3O+ → Cl2 + ClO3– + ClO2 + H2O (สมการที่ 36)
เมื่อวิเคราะห์ปฏิกิริยาของคลอรีน (Cl) โดยแยกออกเป็นปฏิกิริยาครึ่งเซลล์ พบว่า สามารถเกิดปฏิกิริยาที่เป็นไปได้ 3 แบบ ดังสมการที่ 37, 38 และ 39 คือ
2ClO2– + 8H3O+ + 6e– → Cl2 + 12H2O (สมการที่ 37)
ClO2– + 3H2O → ClO3– + 2H3O+ + 2 e– (สมการที่ 38)
ClO2– → ClO2 + e– (สมการที่ 39)
ปฏิกิริยาแบบนี้นิยมเรียกว่า auto-redox ซึ่งสามารถทำให้เกิดออกซิเดชัน 2 แบบ ดังนั้น เมื่อจับคู่ระหว่างสวมการทั้ง 3 เข้าด้วยกัน แล้วดุลสมการตามวิธีที่กล่าวมา ก็จะได้สมการของปฏิกิริยารีดอกซ์ได้ 2 แบบ ดังสมการที่ 40 และ 41 คือ
5ClO2– + 2H3O+ → Cl2 + 3ClO3– + 3H2O (สมการที่ 40)
8ClO2– + 8H3O+ → Cl2 + 6ClO2 + 12H2O (สมการที่ 41)
ที่มา : [1]
เอกสารอ้างอิง
[1] ปริญญา ธีรมงคล, 2532, การดุลสมการเคมีแบบไม่มีลับลมคมใน, วารสารวิทยาศาสตร์ มข., ปีที่ 17 ฉบับที่ 4.

