วัฏจักรซัลเฟอร์ หรือ วัฏจักรกำมะถัน (Sulphur Cycle) หมายถึง การเคลื่อนย้าย และการเปลี่ยนรูปของสารประกอบซัลเฟอร์จากระบบหนึ่งไปสู่ระบบหนึ่ง ทั้งจากในหิน ดิน น้ำ พืช สัตว์ และอากาศ หมุนเวียนเป็นวัฏจักร
1. ซัลเฟอร์ในหิน และดิน
ซัลเฟอร์ในหิน และดิน ถือเป็นแหล่งซัลเฟอร์ที่มีขนาดใหญ่ และเป็นแหล่งกำเนิดของวัฏจักรซัลเฟอร์ที่เปลี่ยนรูปไปสู่อีกระบบหนึ่ง
ซัลเฟอร์ในหินพบได้มากเป็นองค์ประกอบในกลุ่มแร่ต่างๆ ได้แก่
• กลุ่มแร่ซัลไฟด์ ได้แก่ แร่คาลโคไซท์ (chalcocite) แร่บอร์ไนท์ (bronite) แร่สฟาเลอไรท์ (sphalerite) และแร่ไพไรท์ (pyrite) เป็นต้น
• กลุ่มแร่ซัลโฟซอลท์ ได้แก่ แร่เจมโซไนท์ (Pb4FeSb6S14)
• กลุ่มแร่ซัลเฟต ได้แก่ แร่แบร์ไรท์ (barite) แร่แอนไฮไดร์ท (anhydrite) เป็นต้น
แร่ของสารซัลเฟอร์เหล่านี้ เมื่อมีการผุผังหรือถูกย่อยสลายจะปลดปล่อยซัลเฟอร์ออกมาเป็นองค์ประกอบในดินหรือน้ำในรูปของสารประกอบซัลเฟต (SO42-) หรือ อิออนซัลไฟด์ (S2-) ที่สามารถเข้าทำปฏิกิริยากลายเป็นสารประกอบต่างๆ เช่น แมกนีเซียมซัลเฟต (MgSO4) กรดซัลฟูริก (H2SO4) เป็นต้น ซึ่งจะเปลี่ยนรูปเป็นรูปของสารประกอบอยู่ในระบบของดิน และน้ำ
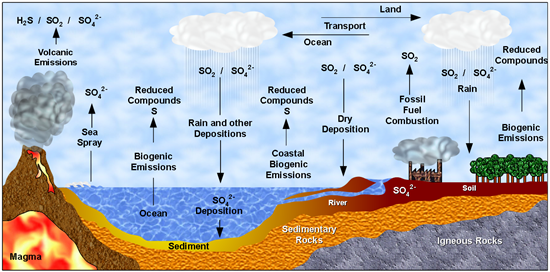
ซัลเฟอร์ในดินเป็นแหล่งที่เกิดจากการย่อยสลาย และผุกร่อนของหินที่ปลดปล่อยซัลเฟอร์ออกมาเข้ารวมกับโลหะหรือธาตุอื่นๆ แต่บางส่วนอาจยังคงเหลือสารประกอบซัลเฟอร์ที่อยู่ในรูปของสินแร่ขนาดเล็กที่ค่อยๆผุผัง และปลดปล่อยซัลเฟอร์ออกมาเรื่อยๆ
ซัลเฟอร์ในดินบางส่วนเกิดจากการย่อยสลายของินทรีย์วัตถุ ซึ่งปลดปล่อยออกมารวมกับสารอื่นในรูปของซัลเฟต แต่ก่อนนั้น ซัลเฟอร์บางส่วนจะถูกรีดิวซ์เป็นไฮโดรเจนซัลไฟด์ (H2S) ก่อนจะถูกออกซิไดซ์กลายมาเป็นซัลไฟด์ (SO3–) และซัลเฟต (SO42-) ตามลำดับ โดยเรียกกระบวนการนี้ว่า Sulfofication Process แต่หากดินไม่มีออกซิเจนที่เพียงพอก็จะเิกิดเป็นไฮโดรเจนซัลไฟด์ (H2S) และ คาร์บอนไดซัลไฟด์ (CS2)
ซัลเฟต (SO42-) ในดินจะถูกพืชดูดซึมเพื่อนำไปใช้ประโยชน์เป็นองค์ประกอบของกรดอะมิโน บางส่วนจะละลายในน้ำในรูปของสารประกอบซัลเฟตต่างๆ นอกจากนั้น พืชยังสามารถดูดซึมซัลเฟอร์นำไปใช้ประโยชน์ได้ในรูปของกรดอะมิโนที่เพิ่งถูกย่่อยสลายใหม่ รวมถึงซัลเฟอร์ที่อยู่ในรูปของก๊าซซัลเฟอร์ไดออกไซด์ (SO2) ด้วย แต่หากบรรยากาศมี SO2 จะเกิดความเป็นพิษต่อพืชได้
ดินที่มีน้ำขัง และมีปริมาณออกซิเจนน้อยจะเกิดสภาพรีดักชันอย่างรุนแรง ทำให้ซัลเฟต (SO42-)ถูกรีดีวซ์เป็นซัลไฟด์ (SO3–) และเกิดเป็นไฮโดรเจนซัลไฟด์ H2S โดยขณะก่อนนั้น Fe+3 จะถูกรีดีวซ์เป็น Fe+2 ซึ่งเกิดก่อนปฏิกิริยารีดักชันของซัลเฟตเป็นซัลไฟด์ เมื่อมี Fe+2 อยู่ในสารละลายดิน Fe+2 จะรวมตัวกับ H2S เกิดเป็น FeS และตกตะกอน
นอกจากนั้น ซัลเฟต (SO42-) และ ซัลไฟด์ (SO3–) บางส่วนจะเข้าทำปฏิกิริยากับน้ำจนได้กรดซัลฟูริก (H2SO4) ทำให้ดินบริเวณนั้นมีสภาพเป็นกรด หรือที่เรียกว่า ดินเปรี้ยว ซึ่งแหล่งดินที่มีสภาพความเป็นกรดมากมักจะพบแร่ในกลุ่มของซัลเฟตมาก
2. ซัลเฟอร์ในน้ำ และน้ำทะเล
ซัลเฟอร์ในน้ำ สามารถพบทั้งในแหล่งน้ำจืืด น้ำเสีย และน้ำทะเล แบ่งได้ ดังนี้
• ซัลไฟล์ทั้งหมด (Total Sulfide) ได้แก่ ไฮโดรเจนซัลไฟล์ที่ละลายน้ำ (Dissolved H2S) อิออนซัลไฟด์ (S2-) อิออนไบซัลไฟด์ (HS–) และสารประกอบของโลหะซัลไฟด์ที่แขวนลอยหรือตกตะกอนในน้ำ เช่น คอปเปอร์ซัลเฟต (CuSO4) โซเดียมซัลเฟต (Na2SO4) แมกนีเซียมซัลเฟต (MgSO4) เป็นต้น
• ซัลไฟล์ละลาย (Dissolved Sulfide) หมายถึง อิออนซัลไฟด์ (S2-) และอิออนไบซัลไฟด์ (HS–) ที่เหลือจากการกำจัดสารแขวนลอย และสารตกตะกอนของซัลไฟด์ออกไปแล้ว
• ก๊าซไฮโดรเจนซัลไฟล์อิสระ (Un-lonized Hydrogen Sulfide) หมายถึง ไฮโดรเจนซัลไฟล์ (H2S) ที่ไม่แตกตัวเป็นเป็นอิออน
น้ำ ที่มี pH ต่ำ จะมีไฮโดรเจนซัลไฟล์มาก ทำให้มีกลิ่นเหม็นมาก ส่วนน้ำที่มี pH ปานกลาง ที่มีไฮโดรเจนซัลไฟด์อยู่จะไม่มีกลิ่นเหม็น และน้ำที่มี pH สูง จะมีไฮโดรเจนซัลไฟด์น้อย และไม่มีกลิ่นเหม็น ทั้งนี้ การเกิดปริมาณของไฮโดรเจนซัลไฟด์แปรผันโดยตรงกับปริมาณกรด (H+) ในน้ำโดยตรง ดังสมการ
SO4 2- + Organic matter → S2- + H2O + CO2
S2- + H+ → HS–
HS– + H+ → H2S
3. ซัลเฟอร์ในพืช และสัตว์
ซัลเฟอร์ จัดเป็นธาตุอาหารหลัก 1 ใน 9 ธาตุ โดยพบเป็นองค์ประกอบในเซลล์พืช และร่างกายสัตว์ และมนุษย์จะอยู่ในรูปของสารประกอบอินทรีย์ที่สำคัญ ได้แก่ โปรตีนหรือกรดอะมิโนชนิดต่างๆ และเคราติน
ซัลเฟอร์ในพืชพบมากที่สุดในส่วนราก และพบได้ในส่วนอื่น อาทิ ลำต้น ใบ ดอก และผล ซึ่งพืชจะใช้ซัลเฟอร์มากที่สุดในระยะการออกดอก ซึ่งหน้าที่ทั่วไปของซัลเฟอร์ที่มีต่อพืช ได้แก่ เป็นองค์ประกอบในการสังเคาะห์โปรตีน ช่วยในการแบ่งเซลล์ กระตุ้นการสังเคราะห์คลอโรฟิลล์ ช่วยเพิ่มปริมาณน้ำมันในพืช ส่งเสริมการเกิดปมรากในพืชตระกูลถั่ว กระตุ้นการสร้างเมล็ด และช่วยเสริมสร้างความแข็งแรงของลำต้น หากพืชขาดซัลเฟอร์มักจะทำให้ใบพืช และลำต้นมีสีเหลือง ลำต้นแคระแกร็น เมล็ดลีบแบน ผลสุกช้า เป็นต้น
เมื่อพืช และสัตว์ตายไปจะเกิดการย่อยสลายด้วยจุลินทรีย์ ทำให้ธาตุซัลเฟอร์ถูกปลดปล่อยออกมาในรูปของก๊าซไฮโดรเจนซัลไฟด์ (H2S) จากกระบวนการย่อยสลายแบบไม่ใช้ออกซิเจน ดังสมการ
สารอินทรีย์ + จุลินทรีย์ (สภาวะไร้อากาศ) → CH4 + CO2 + H2 + H2S
4. ซัลเฟอร์ในอากาศ
ซัลเฟอร์ในรูปของก๊าซไฮโดรเจนซัลไฟด์ (H2S) จะเกิดจากกระบวนการย่อยสลายอินทรีย์วัตถุในสภาวะไร้อากาศ นอกจากนั้น ก๊าซไฮโดรเจนซัลไฟด์ยังสามารถถูกปลดปล่อยสู่บรรยากาศได้จากแหล่งอื่น เช่น การระเบิดของภูเขาไฟ การทำเหมือง การขุดเจาะน้ำมัน เป็นต้น
นอกจากนั้น การเผาไหม้เชื้อเพลิงจากกิจกรรมของมนุษย์ เช่น การเผาถ่านหิน การเผาน้ำมันเตา เผาไหม้เชื้อเพลิงน้ำมันดีเซล รวมถึงการเผาเศษไม้ ใบไม้ ฟางข้าว สิ่งเหล่านี้จะทำให้เกิดก๊าซซัลเฟอร์ไดออกไซด์ (SO2) ลอยสู่บรรยากาศ
ก๊าซไฮโดรเจนซัลไฟด์ที่ลอยในบรรยากาศจะถูกออกซิไดซ์กลายเป็นก๊าซซัลเฟอร์ไดออกไซด์ (SO2) และเมื่อสัมผัสกับน้ำหรือความชื้นจะเกิดการรวมตัวกันเกิดเป็นกรดซัลฟูริกรวมกับน้ำฝนตกลงสู่พื้นดิน หรือที่เรียกว่า ฝนกรด ดังสมการ
2H2S + 3O2 → 2SO2 + 2H2O
2SO2 + O3 → 2SO3
SO3 + H2O → H2SO4

