สูตรเคมี (chemical formulas) คือ สัญลักษณ์ที่ใช้เขียนแทนโมเลกุลของสารที่ประกอบด้วยสัญลักษณ์ของธาตุ และจำนวนอะตอมของธาตุที่เป็นองค์ประกอบโมเลกุลของสารนั้นๆ
ประเภทสูตรเคมี
1. สูตรโมเลกุล (molecular formulas) คือ สูตรเคมีที่แสดงถึงสัญลักษณ์ของธาตุ และจำนวนอะตอมของธาตุที่เป็นองค์ประกอบของสารนั้นใน 1 โมเลกุล เช่น
H2O (น้ำ) จำนวน 1 โมเลกุล ประกอบด้วย H 2 อะตอม และ O 1 อะตอม
CCl4 (คาร์บอนเตรตะคลอไรด์) จำนวน 1 โมเลกุล ประกอบด้วย C 1 อะตอม และ Cl 4 อะตอม
C6H12O6 (น้ำตาลโมเลกุลเดี่ยว) จำนวน 1 โมเลกุล ประกอบด้วย C 6 อะตอม, H 12 อะตอม และ O 6 อะตอม
H2SO4 (กรดซัลฟูริก) จำนวน 1 โมเลกุล ประกอบด้วย H 2 อะตอม, S 1 อะตอม และ O 4 อะตอม
NaCl (เกลือ) จำนวน 1 โมเลกุล ประกอบด้วย Na 1 อะตอม และ Cl 1 อะตอม
2. สูตรอย่างง่าย หรือ สูตรเอมพิริคัล (empirical formulas) คือ สูตรเคมีที่แสดงถึงอัตราส่วนอย่างต่ำของจำนวนอะตอมของธาตุที่เป็นองค์ประกอบ นิยมใช้เขียนแสดงสูตรของสารประกอบไอออนิกที่ไม่มีสูตรโมเลกุลที่แน่นอน เช่น
H2O2 สูตรอย่างง่ายคือ HO
C6H12O6 สูตรอย่างง่ายคือ CH2O
C4H10 สูตรอย่างง่ายคือ C2H5
C2H2 สูตรอย่างง่ายคือ CH
3. สูตรโครงสร้าง (structural formulas) คือ สูตรเคมีที่แสดงถึงองค์ประกอบของธาตุ และจำนวนอะตอมของธาตุที่มีการจัดเรียงตัวในลักษณะต่างๆ สามารถเขียนได้ 2 แบบ คือ
3.1 สูตรโครงสร้างในระนาบ 2 มิติ แบ่งออกเป็น 2 แบบ คือ
– สูตรโครงสร้างแบบเส้น (dash formulas) เป็นสูตรโครงสร้างที่ใช้วิธีการเขียนเส้นตรงแทนอิเล็กตรอนจำนวน 1 คู่ เช่น
น้ำตาลกลูโคส
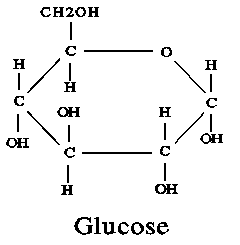
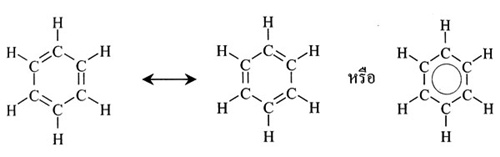
เบนซีน
คีโตน และอัลดีไฮด์
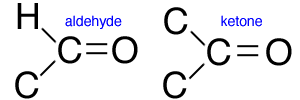
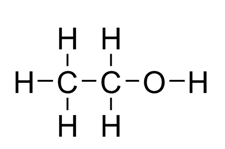
เอทิลแอลกอฮอล์
– สูตรโครงสร้างแบบจุดอิเล็กตรอน (electron-dot formulas) หรือ สูตรลิวอิส ที่เสนอโดยลิวอิส (G. N. Lewis) โดยการเขียนจุด (.) ที่หมายถึงจำนวน 1 อิเล็กตรอน ไว้รอบข้างสัญลักษณ์ของธาตุในโมเลกุลนั้น เช่น
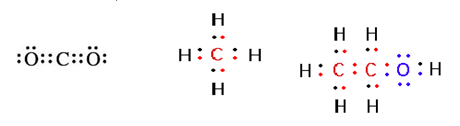
3.2 สูตรโครงสร้างในปริภูมิ 3 มิติ
เช่น สูตรโครงสร้างของเอทิลแอลกอฮอล์จากแบบเส้นเป็นแบบ 3 มิติ

การคำณวนสูตรเอมพิริคัล และสูตรโมเลกุล
สูตรเอมพิริคัลหรือสูตรอย่างง่าย เป็นสูตรเคมีที่แสดงถึงอัตราส่วนอะตอมอย่างต่ำของแต่ละธาตุที่เป็นองค์ประกอบในโมเลกุล เช่น ไฮโดรเจนเปอร์ออกไซด์ (H2O2) มีอัตราส่วนอะตอมอย่างต่ำของธาตุ H และ O เป็น 1:1 เขียนเป็นสูตรเอมพิริคัล คือ HO ซึ่งมีหลักในการหาสูตร คือ
– ต้องทราบชนิดธาตุที่เป็นองค์ประกอบสารนั้นๆ
– ต้องทราบมวลอะตอมของแต่ละธาตุที่เป็นองค์ประกอบ
– ต้องทราบมวลของแต่ละธาตุที่เป็นองค์ประกอบ
– คำนวณหาสูตรเอมพิริคัลจากอัตราส่วนโดยโมล ด้วยการนำมวลหารด้วยมวลอะตอมของแต่ละธาตุ
– การปัดจุดทศนิยมจากการหาร หากเป็นจุดทศนิยม 0.1-0.2 ให้ปัดทิ้ง หากเป็นจุดทศนิยม 0.8-0.9 ให้ปัดเพิ่มขึ้น 1 หากตัวเลขมีค่า 0.0-0.7 ให้นำตัวเลขที่มีค่าน้อยที่สุดมาคูณกับอัตราส่วนโดยโมลให้มีค่าใกล้เคียงกับจุดที่จะปัดเสียก่อน
2. สูตรโมเลกุล เป็นสูตรเคมีที่แสดงถึงสัญลักษณ์ของธาตุ และจำนวนอะตอมของธาตุที่เป็นองค์ประกอบของสารนั้นใน 1 โมเลกุล เช่น ไฮโดรเจนเปอร์ออกไซด์ (H2O2) 1 โมเลกุล ประกอบด้วย H 2 อะตอม และ O 2 อะตอม มีหลักการหาสูตร คือ
– ต้องทราบสูตรเอมพิริคัล
– ต้องทราบจำนวนมวลโมเลกุลของแต่ละธาตุ
– หาค่า n โดยใช้สูตร
(มวลจากสูตรเอมพิริคัล) x n = มวลโมเลกุล
โดยที่ n = เลขจำนวนเต็มบวก เช่น 1, 2, 3, …
– การปัดจุดทศนิยม หากตัวเลขทศนิยมมีค่าตั้งแต่ 0.5 ขึ้นไป ให้ปัดเป็น 1 หากตัวเลขทศนิยมมีค่าน้อยกว่า 0.5 ให้ปัดทิ้ง เช่น 2.5 ให้ปัดเป็น 3.0 ส่วนตัวเลขเป็น 2.4 ให้ปัดลงเป็น 2.0 เป็นต้น
การคำนวณมวลร้อยละจากสูตรเคมี
ร้อยละ หรือ ส่วนใน 100 ส่วน (past per hundred, pph) ด้วยการหาจากสูตรเคมี แบ่งเป็น 3 อย่าง คือ
1. ร้อยละโดยมวล หรือน้ำหนัก (มวล/มวล) หมายถึง ปริมาณมวลของสารตัวถูกละลายที่ละลายในตัวทำละลาย 100 หน่วย โดยมวลเดียวกัน เช่น หน่วยเป็น มิลลิกรัม (mg), กรัม (g), กิโลกรัม (kg) เป็นต้น ร้อยละโดยมวลคำนวณได้จากสูตร
ร้อยละโดยมวล A = (มวล A/มวลตัวทำละลาย) x 100
ตัวอย่างการคำนวณมวลจากสูตรเคมี
Na2CO3 จำนวน 1 โมล มีมวลโมเลกุล 106 กรัม ที่ประกอบด้วย
Na จำนวน 2 อะตอม มีมวลโมเลกุล 23 = 2 x 23 กรัม เป็น 46 กรัม
C จำนวน 1 อะตอม มีมวลโมเลกุล 12 = 1 x 12 กรัม เป็น 12 กรัม
O จำนวน 3 อะตอม มีมวลโมเลกุล 16 = 3 x 16 กรัม เป็น 48 กรัม
ดังนั้น Na2CO3 จำนวน 1 โมล มีน้ำหนักเท่ากับ 46+12+48 กรัม หรือ 106 กรัม
ตัวอย่างการคำนวณ
สารละลายชนิดหนึ่งเตรียมได้จากการละลาย 10 กรัม ของ Na2SO4.10H2O ในน้ำ 100 กรัม แล้วจะมี Na2SO4 ละลายอยู่กี่เปอร์เซ็นต์โดยมวลของสารละลาย
การคำนวณ
มวลจากสูตรเคมี Na2SO4.10H2O = 322 กรัม
มวลจากสูตรเคมี Na2SO4 = 142 กรัม
สาร Na2SO4.10H2O ที่เติมในน้ำ 10 กรัม จะมี Na2SO4 = (142x 10) /322 = 4.41 กรัม
ดังนั้น % โดยมวล Na2SO4 = (มวล Na2SO4/(มวล Na2SO4.10H2O + มวลน้ำ)) x 100
= (4.1/(10 + 100)) x 100
= 4.01% โดยมวล
2. ร้อยละโดยปริมาตร (ปริมาตร/ปริมาตร) หมายถึง ปริมาตรของสารตัวถูกละลายที่ละลายในตัวทำละลาย 100 หน่วย โดยปริมาตรเดียวกัน เช่น หน่วยเป็น ลูกบาศก์เมตร (m3), ลูกบาศก์เซนติเมตร (cm3) เป็นต้น ร้อยละโดยปริมาตรคำนวณได้จากสูตร
ร้อยละโดยปริมาตร A = (ปริมาตร A/ปริมาตรตัวทำละลาย) x 100
ตัวอย่างการคำนวณ
เตรียมสารละลายน้ำส้มสายชูให้เจือจาง โดยเติมสารละลายน้ำส้มสายชูความเข้มข้น 50% จำนวน 200 ซีซี ลงในน้ำ 1000 ซีซี แล้วจะได้สารละลายน้ำส้มสายชูความเข้มข้นกี่เปอร์เซ็นต์โดยปริมาตร
การคำนวณ
c1v1 = c2v2
50 x 200 = c2 x 1200 (ปริมาตรน้ำ 1000+ ปริมาตรสารละลาย 200)
10000 = c2 x 1200
c2 = 10000/1200
c2 = 8.33% โดยปริมาตร
หมายเหตุ
c1 = ความเข้มข้นของสารตั้งต้น
c2 = ความเข้มข้นของผลิตภัณฑ์
v1 = ปริมาตรสารตั้งต้น
v2 = ปริมาตรสารผลิตภัณฑ์
3. ร้อยละโดยมวล/ปริมาตร (มวล/ปริมาตร) หมายถึง ปริมาณมวลของสารตัวถูกละลายที่ละลายในตัวทำละลาย 100 หน่วยปริมาตร ร้อยละโดยมวล/ปริมาตรคำนวณได้จากสูตร
ร้อยละโดยมวล/ปริมาตร A = (มวล A/ปริมาตรตัวทำละลาย) x 100
ตัวอย่างการคำนวณ
เตรียมสารละลายน้ำส้มสายชู โดยใส่แอซิตริก (CH3COOH) จำนวน 10 กรัม ลงในน้ำ 100 ซีซี แล้วจะได้สารละลายน้ำส้มสายชูความเข้มข้นกี่เปอร์เซ็นต์โดยปริมาตร (ความหนาแน่น CH3COOH = 1.2)
การคำนวณ
D = m/v
1.2 = 10/v
v = 10/1.2 = 8.33
ดังนั้น ปริมาตรรวมทั้งหมดเท่ากับ 100+8.33 = 108.33 ซีซี
หาความเข้มข้นโดยปริมาตรได้เท่ากับ (8.33/108.33) x 100 = 7.69 เปอร์เซ็นต์ โดยปริมาตร

