ข้อมูลเบื้องต้น
สารบัญเรื่อง
ปฏิกิริยาเคมี คือ กระบวนการเปลี่ยนของสารตั้งต้นไปเป็นสารใหม่ โดยปริมาณสารตั้งต้นจะลดลง และปริมาณสารใหม่จะเกิดขึ้น และเพิ่มปริมาณขึ้นเรื่อยๆ เมื่อเวลาผ่านไป โดยสามารถเขียนให้เข้าใจง่ายด้วยสมการเคมี
ปฏิกิริยาเคมีจำแนกเป็น 2 ประเภท คือ
1. ปฏิกิริยาเคมีสมบูรณ์ คือ การเกิดสารใหม่ขณะที่สารตั้งต้นตัวใดตัวหนึ่งหมดไปหรือหมดทุกตัว
2. ปฏิกิริยาเคมีไม่สมบูรณ์ คือ การเกิดสารใหม่ขณะที่สารตั้งต้นยังเหลือทุกตัว ไม่มีตัวใดตัวหนึ่งหมดไป
ทฤษฎีที่เกี่ยวข้องกับปฏิกิริยาเคมี
1. ทฤษฎีการชนโมเลกุล (Collision Theory) กล่าวถึง โมเลกุลของสารต้องมีการชนซึ่งกันและกัน ซึ่งการชนกันแต่ละครั้งไม่จำเป็นต้องเกิดปฏิกิริยา
2. ทฤษฎีจลน์ของโมเลกุล (Kinetic Theory) กล่าวถึง โมเลกุลต้องมีการเคลื่อนที่ช้าลง ซึ่งก่อให้เกิดพลังงานจลน์ โดยโมเลกุลต้องมีพลังงานสูงพอจึงจะเกิดปฏิกิริยาได้
สถานะการเกิดปฏิกิริยาเคมี
1. ต้องมีจำนวนโมเลกุลมากพอ
2. ต้องมีการชนกันระหว่างโมเลกุล
3. ต้องมีพลังงานสูงพอ โดยอย่างน้อยต้องเท่ากับพลังงานก่อกัมมันต์
4. ต้องมีทิศทางที่เหมาะสม
ศาสตร์ทางเคมีที่เกี่ยวข้องกับการศึกษาอัตราการเกิดปฏิกิริยาเคมี เรียกว่า จลนศาสตร์เคมี (chemical kinetics) โดยคำว่า จลนศาสตร์ มีความหมายเกี่ยวข้องกับการเคลื่อนที่ของสาร ซึ่งเกี่ยวข้องกับอัตราการเกิดปฏิกิริยาเคมี (Rate of chemical reaction) โดยการเกิดปฏิกิริยาหนึ่งๆที่อยู่ในสภาวะเดียวกันจะมีอัตราการเกิดปฏิกิริยาเฉพาะค่า โดยขึ้นอยู่กับสภาวะธรรมชาติของสารนั้นๆ เช่น อัตราการเกิดปฏิกิริยาของก๊าซไฮโดรเจนกับก๊าซฟลูออรีน และก๊าซไนโตรเจน
H2 (g) + F2 (g) = 2HF อัตราการเกิดปฏิกิริยาเร็ว
3H2 (g) + N2 (g) = 2NH3 อัตราการเกิดปฏิกิริยาช้า
อัตราการเกิดปฏิกิริยาเคมี
อัตราการเกิดปฏิกิริยาเคมี (Rate of chemical reaction) หมายถึง การเปลี่ยนแปลงปริมาณสารในหนึ่งหน่วยเวลาของการเกิดปฏิกิริยาของสารนั้น
อัตราการเกิดปฏิกิริยาเคมี = ปริมาณสารตั้งต้นที่ลดลง
**********************************เวลา
อัตราการเกิดปฏิกิริยาเคมี = ปริมาณสารที่เปลี่ยนไป
*********************************เวลา
อัตราการเกิดปฏิกิริยาเคมี = ปริมาณสารที่เพิ่มขึ้น
********************************เวลา
ชนิดอัตราการเกิดปฏิกิริยาเคมี แบ่งเป็น 2 ชนิด
1. อัตราการเกิดปฏิกิริยาเฉลี่ย หมายถึง อัตราการเกิดปฏิกิริยาที่คำนวณจากการเปลี่ยนแปลงปริมาณสารทั้งหมดในหนึ่งหน่วยเวลา
2. อัตราการเกิดปฏิกิริยา ณ ขณะใดขณะหนึ่ง หมายถึง อัตราการเกิดปฏิกิริยาที่คำนวณจากการเปลี่ยนแปลงปริมาณสารในช่วงเวลาใดเวลาหนึ่ง
สรุปประเด็นที่เกี่ยวข้อง
1. ปฏิกิริยาเคมีหนึ่งๆ จะมีขั้นตอนการเกิดปฏิกิริยาหลายขั้นตอน ทั้งขั้นที่เกิดเร็ว และขั้นที่เกิดช้า โดยมีขั้นสำหรับควบคุมปฏิกิริยาหรือขั้นกำหนดอัตรา (Rate determing step) คือ ขั้นที่ดำเนินไปที่ช้าที่สุด
2. ขณะที่การเกิดปฏิกิริยาเคมีดำเนินไป ปฏิกิริยาเคมีในขั้นเริ่มต้นจะมีอัตราการเกิดที่รวดเร็ว เนื่องจากปริมาณสารตั้งต้นมีมาก และเมื่อปฏิกิริยาผ่านไประยะหนึ่ง อัตราการเกิดปฏิกิริยาจะช้าลงเมื่อเทียบกับในช่วงเริ่มต้น เนื่องจากปริมาณสารตั้งต้นมีปริมาณลดลง
3. สารเคมีแต่ละชนิดในปฏิกิริยาเคมีจะมีอัตราเร็วไม่เท่ากัน
4. การคำนวณหาอัตราการเกิดปฏิกิริยา สามารถหาได้จากสารใดก็ได้ ด้วยวิธี คือ
– หากเป็นของแข็ง สามารถหาได้โดยการชั่งน้ำหนัก
– หากเป็นของเหลว สามารถหาได้โดยการชั่งน้ำหนักหรือการวัดปริมาณ
– หากเป็นสารละลาย สามารถหาได้จากความเข้มข้น
– หากเป็นก๊าซ สามารถหาได้โดยการวัดปริมาตรหรือวัดความดัน
5. การหาอัตราการเกิดปฏิกิริยาเคมี สามารถหาได้จากสารตัวใดตัวหนึ่งก็ได้ ซึ่งจะให้ค่าที่เท่ากัน ตามสูตรด้านล่าง
อัตราการเปลี่ยนแปลงของสาร = ΔA***** ↔*****ΔB***** ↔*****ΔC***** ↔*****ΔD
********************************–Δt*************–Δt*************+Δt************+Δt
อัตราการเกิดปฏิกิริยาเคมี = ΔA***** ↔*****ΔB***** ↔*****ΔC***** ↔*****ΔD
***************************-Δt************-3Δt************+2Δt***********+4Δt
หมายเหตุ: Δ = ผลต่าง, t = เวลา, + = การเพิ่มขึ้น, – = การลดลง
6. อัตราการเกิดปฏิกิริยาเคมีจะเท่ากับอัตราการเปลี่ยนแปลงของโมลสารหารด้วยหารด้วยสัมประสิทธิ์จำนวนโมลของสารนั้นที่ได้จากการดุลสมการแล้ว
กฏอัตรา
กฏอัตรา คือ สมการที่แสดงความสัมพันธ์ระหว่างอัตราการเกิดปฏิกิริยาเคมีกับความเข้มข้นของสารตั้งต้นหรือสารที่เข้าทำปฏิกิริยา เช่น
2A + 3B + C = 2D
อัตรา (Rate) = -1 d(A) = -1 d(B) = –d(C) = -1 d(D)
************** 2 dt 3 dt dt 2 dt
อัตราการเกิดปฏกิริยาเคมี (rate) = k(A)x (B)y (C)z
หมายเหตุ:
k = ค่าคงที่ของปฏิกิริยา (specific rate constant) และค่า k จะเปลี่ยนเมื่อ t เปลี่ยน โดยค่า k มีค่ามากแสดงถึงอัตราการเกิดปฏิกิริยาที่ดี
x,y,z = ลำดับการเกิดปฏิกิริยาเมื่อเทียบกับความเข้มข้นของสาร A, B และC
(A) (B) (C) = ความเข้มข้นของสาร A, B และC หน่วย โมล/ลิตร
x + y + z = ลำดับรวมของปฏิกิริยา (order of reaction)
ทั้งนี้ ลำดับปฏิกิริยาจะหาได้จากการทดลองเท่านั้น โดยไม่มีความสัมพันธ์กับตัวเลขด้านหน้าของสารของสสมการเคมีที่ดุลแล้ว
ปัจจัยที่มีผลต่อการเกิดปฏิกิริยาเคมี
1. ธรรมชาติของสารตั้งต้น และผลิตภัณฑ์
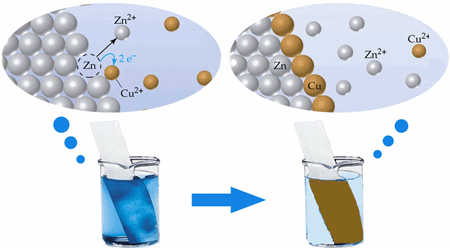
ความเร็วหรือช้าของการเกิดปฏิกิริยาเคมีจะขึ้นอยู่กับสภาพธรรมชาติของสารเหล่านั้น เช่น สารประเภทไอออนิกที่เข้าทำปฏิกิริยากันจะเกิดความเร็วของปฏิกิริยาได้ดีกว่าสารที่เป็นโควาเลนท์ หรือสารทำปฏิกิริยาที่เป็นก๊าซจะทำปฏิกิริยาได้เร็วกว่าสารที่มีสถานะอื่น
2. ความเข้มข้นสารตั้งต้น และผลิตภัณฑ์
ความเร็วของปฏิกิริยาจะแปรผันตามความเข้มข้นของสารตั้งต้น และจะแปรผกผันกับความเข้มข้นของสารผลิตภัณฑ์ กล่าวคือ เมื่อปริมาณสารตั้งต้นมีมากอัตราการเกิดปฏิกิริยาก็จะเร็ว และเมื่อเวลาผ่านไปปริมาณสารตั้งต้นลดลง ปฏิกิริยาก็จะค่อยๆลดลงตามปริมาณผลิตภัณฑ์ที่เพิ่มขึ้น
3. พื้นที่ผิว
พื้นที่ผิวของสารจะเป็นจุดของการเกิดปฏิกิริยา หากสารมีพื้นที่ผิวมากก็จะทำให้เกิดปฏิกิริยาได้เร็วขึ้น เช่น การทำปฏิกิริยาของหินปูนกับกรดไฮโดรคลอริกจะได้ก๊าซคาร์บอนไดออกไซด์ หากหินปูนมีความละเอียดเป็นผงขนาดเล็ก มีพื้นที่ผิวมากก็ย่อมทำปฏิกิริยากับกรดไฮโดรคลอริกได้อย่างรวดเร็ว
4. อุณหภูมิ
อุณหภูมิถือเป็นปัจจัยหนึ่งที่ช่วยกระตุ้นความเร็วของการเกิดปฏิกิริยา เช่น การอุ่นน้ำมันด้วยความร้อนเพียงน้อยนิดจะทำให้น้ำมันอุ่นเท่านั้น แต่หากเพิ่มความร้อนจนทำให้น้ำมันกลายเป็นไอก็สามารถลุกติดไฟได้ง่าย
5. ความดัน
ความดันที่เกี่ยวข้องกับอัตราการเกิดปฏิกิริยาเคมีมักพบมากในสารที่เป็นก๊าซ เพราะการเพิ่มความดันให้ก๊าซจะทำให้โมเลกุลของก๊าซเกิดการชนกันมากขึ้น
สมการเคมี
สมการเคมี (chemical equation) คือ สัญลักษณ์ที่เขียนขึ้นแทนปฏิกิริยาเคมีของการทำปฏิกิริยาเคมีของสารตั้งต้น ทำให้เกิดสารผลิตภัณฑ์ใหม่เมื่อเวลาผ่านไป
หลักการดุลสมการเคมี
1. เขียนสูตรเคมีของสารตั้งต้นไว้ด้านซ้ายมือ
2. เขียนสูตรเคมีของสารผลิตภัณฑ์ไว้ด้านขวามือ โดยใช้สัญลักษณ์ → คั่นกลาง
3. ระบุสถานะของสารตั้งต้น และสารผลิตภัณฑ์ในวงเล็บด้านหลังของสารนั้นๆ ได้แก่ (s) = ของแข็ง, (l) = ของเหลว, (g) = ก๊าซ และ (aq) = สารละลาย
4. ทำการดุลสมการเคมี โดยทำให้ตัวเลขอะตอมของทุกธาตุในด้านซ้ายมือ และด้านขวามือเท่ากันด้วยการเติมตัวเลขใดใส่ด้านหน้าของสารเหล่านั้นที่ เมื่อคูณกับจำนวนเลขอะตอมของแต่ละธาตุแล้วสามารถทำให้เลขอะตอมของธาตุด้าน ซ้ายมือ และขวามือเท่ากัน เช่น
2KMnO4 (s) + 16HCl (aq) → 2KCl (aq) + 2MnCl (aq) + 8H2O (l) + 5Cl2 (g)
การทดสอบว่าการดุลสมการถูกต้องหรือไม่ เพื่อให้ทราบผลที่แน่ชัด และถูกต้องนั้น สามารถทดสอบด้วยวิธีการทดลองทางเคมี ที่เรียกว่า การไทเตรต (titration) เช่น การทำปฏิกิริยาระหว่างกรดกับเบส ณ จุดที่ทำปฏิกิริยากันพอดีจะอยู่ที่จุดอุณหภูมิสูงสุด การทำปฏิกิริยาระหว่างหว่างออกซิเจน (O2) กับแมกนีเซียมซัลเฟต (MnSO4) และโพแทสเซียมไฮดรอกไซด์ (2KOH) ในการฟิกออกซิเจนจนเกิดตะกอนน้ำตาลแดงของ 2MnO(OH)2
สมการเคมีที่สมดุลแล้วจะสามารถแสดงความสัมพันธ์ของปริมาณ สารในสมการ ได้แก่ จำนวนโมล จำนวนมวลสาร จำนวนโมเลกุล และจำนวนปริมาตร ตัวอย่างเช่น
ตัวอย่างที่ 1
****************2KMnO4 (s) + 16HCl (aq) → 2KCl (aq) + 2MnCl (aq) + 8H2O (l) + 5Cl2 (g)
จำนนวนโมล: 2 โมล 16 โมล 2โมล 2 โมล 8 โมล 5 โมล
จำนวนมวลสาร: 2×158 g 16×36.5 g 2×74.5 g 2×126 g 8×18 g 5×71 g
จำนวนโมเลกุล: 2×6.02×1023 16×6.02×1023 2×6.02×1023 2×6.02×1023 8×6.02×1023 5×6.02×1023
ปริมาตรที่ STP: 2×22.4xdm3 16×22.4xdm3 2×22.4xdm3 2×22.4xdm3 8×22.4xdm3 5×22.4xdm3
ตัวอย่างที่ 2
************ ****Al (s) + 6HCl (aq) → 2AlCl (aq) + 3H2 (g)
จำนนวนโมล: 1 โมล 6 โมล 2โมล 3 โมล
จำนวนมวลสาร: 1×27 g 16×36.5 g 2×62.5 g 3×2 g
จำนวนโมเลกุล: 1×6.02×1023 6×6.02×1023 2×6.02×1023 3×6.02×1023
ปริมาตรที่ STP: 1×22.4xdm3 6×22.4xdm3 2×22.4xdm3 3×22.4xdm3
กฏทรงมวล
สิ่งแวดล้อม หมายถึง ส่วนที่อยู่ภายนอกขอบเขตการศึกษา เช่น ภาชนะ อุปกรณ์ เตรื่องมืดวัด อากาศโดยรอบ เป็นต้น
ระบบ หมายถึง ส่วนที่อยู่ภายในขอบเขตการศึกษาที่ประกอบด้วยก่อนการเปลี่ยนแปลง และหลังการเปลี่ยนแปลง ประกอบด้วย 2 ระบบ คือ
1. ระบบปิด คือ ระบบที่ไม่มีการถ่ายเทหรือแลกเปลี่ยนมวลสารกับสิ่งแวดล้อมทำให้มีปริมาณมวลสารในระบบเท่าเดิม
2. ระบบเปิด คือ ระบบที่มีการถ่ายเทหรือแลกเปลี่ยนมวลสารกับสิ่งแวดล้อมทำให้มีปริมาณมวลสารในระบบลดลงหรือเพิ่มขึ้น
หากมวลสารทำปฏิกิริยาในระบบปิดจะทำให้ปริมาณสารก่อนทำปฏิกิริยา และหลังทำปฏิกิรยามีปริมาณเท่ากัน สมมติฐานนี้ถูกอธิบายด้วยกฏของอองตวน-โลรอง ในปี พ.ศ. 2317 ที่ได้ทำการทดลองเผาสารในหลอดที่ปิดสนิท ซึ่งพบว่า มวลรวมของสารก่อนการเกิดปฏิกิริยา และหลังการเกิดปฏิกิริยามีปริมาณเท่ากัน จึงตั้งกฏนี้ว่า “กฏทรงมวล”
ปริมาตรก๊าซในปฏิกิริยาเคมี
ก๊าซ มีสมบัติในการฟุ้งกระจาย และมีมวลน้อย ดังนั้น การวัดมวลสารโดยตรงจึงทำได้ยาก ปัจจุบันจึงนิยมวัดในหน่วยปริมาตรแทน โดยใช้กฎต่อไปในการอธิบาย
1. กฎของเกย์ลุสแซก
กฎ นี้เกิดขึ้นเมื่อปี พ.ศ. 2351 เมื่อ โซเซฟ ลุย เก ลุสแซก ได้ทำการวัดปริมาตรของก๊าซที่ทำปฏิกิริยากันพอดี ณ อุณหภูมิ และความดันเดียวกัน แล้วสรุปเป็นกฎการรวมปริมาตรของก๊าซว่า “ในปฏิกิริยาเคมีที่เป็นก๊าซ อัตราส่วนโดยปริมาตรของก๊าซที่ทำปฏิกิริยากันพอดี และปริมาตรของก๊าซที่เกิดปฏิกิริยา ณ อุณหภูมิ และความดันเดียวกันจะเป็นเลขจำนวนเต็มลงตัวน้อยๆ”
2. กฎอาโวกาโดร
ปี พ.ศ. 2354 อาเมเดโอ อาโวกาโดร ได้ศึกษากฎของเกย์ลุสแซก ได้อธิบายถึงอัตราส่วนโดยปริมาตรของก๊าซที่เข้าทำปฏิกิริยา และที่ได้จากปฏิกิริยาเป็นเลขจำนวนเต็มจำนวนน้อย อาจเนื่องจากปริมาตรของก๊าซมีความสัมพันธ์กับจำนวนอนุภาคที่รวมตัวกันเป็น สารประกอบอาโวกาโดร พร้อมเสนอสมมติฐานขึ้นว่า “ณ อุณหภูมิ และความดันเดียวกันก๊าซทุกชนิดที่มีปริมาตรเท่ากันจะมีจำนวนโมเลกุลเท่ากัน” เช่น
ปฏิกิริยาของก๊าซไฮโดรเจนกับออกซิเจนเกิดเป็นน้ำ
******H2 + O2 = H2O
** 2 cm3 + 1 cm3 2 cm3
**2n โมเลกุล n โมเลกุล 2n โมเลกุล
**2 อะตอม 1 อะตอม 2 อะตอม

