ก๊าซซัลเฟอร์ไดออกไซด์ (sulfur dioxide : SO2) เป็นก๊าซที่พบมากในบรรยากาศที่เกิดจากการเผาไหม้ของเชื้อเพลิงในภาคการขนส่ง อุตสาหกรรม ครัวเรือน และจากธรรมชาติ จัดเป็นก๊าซพิษ แต่ก็มีประโยชน์สำหรับภาคการเกษตร และอุตสาหกรรม เช่น ใช้ฆ่าเชื้อ ใช้ฟอกสี เป็นต้น
คุณสมบัติทางเคมี และกายภาพ
• สูตรเคมี : H2SO4
• มวลโมเลกุล : 64.07 กรัม/โมล
• ความหนาแน่น : 2.551 กรัม/ลิตร (ก๊าซ) : 1.46 กรัม/ลบ.ซม. (ของเหลวที่ −10 °C)
• มีสถานะ : เป็นก๊าซ ไม่มีสี มีกลิ่นฉุน
• จุดเดือด : -10.02 °C
• จุดหลอมเหลว : -72.7 °C
• ความหนาแน่นในอากาศที่ 0 °C : 2.263 มากกว่าอากาศ
• ความหนาแน่นของสารละลายที่ -20 °C : 1.15 กรัม/ลบ.ซม.
• ค่าพลังงานจากการเผาไหม้ : 7.40 กิโลจูล/โมล
• ค่าพลังงานการระเหยที่ : -10 °C 24.92 กิโลจูล/โมล
• อุณหภูมิวิกฤต : 157.6 °C
• ความดันวิกฤต : 7911 กิโลพาสคาล
• ปริมาตรวิกฤต : 122.0 ลบ.ซม./กรัม
• ละลายน้ำได้ดี : กรัม/100 มิลลิลิตร
– ที่ -10 °C ละลายได้ 11.3
– ที่ 0 °C ละลายได้ 22.971
– ที่ 10 °C ละลายได้ 16.413
– ที่ 20 °C ละลายได้ 11.577
– ที่ 30 °C ละลายได้ 8.247
– ที่ 40 °C ละลายได้ 5.881
• ไม่ติดไฟ
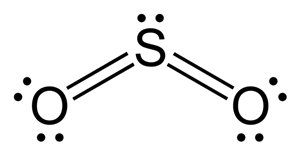
ปฏิกิริยาซัลเฟอร์
ปฏิกิริยาออกซิไดซ์
ปฏิกิริยาจากการเผาไหม้ :
S (Fuel) + O2 → SO2
ปฏิกิริยาในอากาศ :
SO2 + 1/2 O2 → SO3
2H2S + SO2 → 2H2O + 3S
ปฏิกิริยากับสารละลาย :
SO3 + H2O → H2SO4
H2SO3 + NaOH → NaH2SO3 + H2O
SO2 + 2HNO3 → H2SO4 + 2NO2
แหล่งของก๊าซซัลเฟอร์ไดออกไซด์
ก๊าซซัลเฟอร์ไดออกไซด์ (SO2) เป็นก๊าซพิษที่เกิดจากการเผาไหม้ของเชื้อเพลิงที่มีกำมะถัน (S) เป็นองค์ประกอบ มีแหล่งกำเนิดที่สำคัญ ได้แก่ ถ่านหิน น้ำมันดีเซลล์ น้ำมันเบนซิน เตาเผาขยะ เตาเผาศพ เป็นต้น ปริมาณที่ถูกปลดปล่อยจากการเผาไหม้จะสัมพันธ์กับปริมาณของซัลเฟอร์ที่พบในเชื้อเพลิง

ประโยชน์ก๊าซซัลเฟอร์ไดออกไซด์
1. ใช้เป็นสารตั้งต้นผลิตกรดซัลฟูริก H2SO4
2. ใช้สำหรับการรมควันผลิตภัณฑ์การเกษตรเพื่อฆ่าเชื้อรา เชื้อแบคทีเรีย แมลง สำหรับยืดอายุการเก็บรักษา และปรับปรุงคุณสมบัติของผลิตภัณฑ์ เช่น ยับยั้งการเปลี่ยนสีน้ำตาลของเปลือกในลำไย ทำให้เปลือกลำไยดูสด และคงสภาพนาน แต่มีข้อเสีย คือ พบการตกค้างของ SO2 ในผลิตภัณฑ์ ผู้ใช้มีความเสี่ยงต่อโรคในระบบทางเดินหายใจ
3. ใช้เป็นสารในอุตสาหกรรมฟอกสีหนัง ฟอกสีผลิตภัณฑ์อาหาร เช่น ฟอกสีแป้งถั่วเขียวในการผลิตวุ้นเส้น
4. ใช้ในระบบทำความเย็น
ความเข้มข้น และผลกระทบ
– ความเข้มข้น 3-5 ppm เริ่มรับกลิ่นได้
– ความเข้มข้น 8-12 ppm ทำให้แสบคอ
– ความเข้มข้น 20 ppm ระคายเคืองต่อเยื่อบุตา และระบบทางเดินหายใจ มีอาการแสบตา แสบจมูก แสบคอ
– ความเข้มข้น 1500 ไมโครกรัม/ลบ.ม. (24 ซม.) ทำให้เพิ่มอัตราการตายสูงขึ้น
– ความเข้มข้นมากกว่า 750 ไมโครกรัม/ลบ.ม. (24 ซม.) อาจเพิ่มอัตราการตายต่อวันสูงขึ้น
– ความเข้มข้นมากกว่า 300-500 ไมโครกรัม/ลบ.ม. (24 ซม.) เพิ่มอัตราผู้ป่วยเข้ารักษาด้วยโรคระบบทางเดินหายใจ
– ความเข้มข้นมากกว่า 345 ไมโครกรัม/ลบ.ม. มีผลต่อการกัดกร่อนวัสดุ โดยเฉพาะวัสดุโลหะ
– ความเข้มข้นมากกว่า 85 ไมโครกรัม/ลบ.ม. พืชใบร่วง และเกิดโรคพืชเรื้อรัง
ผลแบบเฉียบพลัน
ก๊าซซัลเฟอร์ไดออกไซด์ (SO2) ที่ความเข้มข้น 3-5 ppm จะเป็นความเข้มข้นที่มนุษย์เริ่มได้กลิ่น หากมีความเข้มข้นเพิ่มขึ้นจะมีผลกระทบต่อร่างกาย ได้แก่
– ระคายเคืองตา แสบตา
– ระคายเคืองต่อเยื่อบุโพรงจมูก คอ และอวัยวะภายในระบบทางเดินหายใจ มีอาหารแสบ แน่นหน้าอก การทำงานของปอดลดลง
– มีอาการบีบรัดตัวของระบบทางเดินหายใจ ทำให้หายใจลำบาก มีอาการหอบหืด แน่นหน้าอก
– อัตราการเต้นของชีพจรเปลี่ยนแปลง ความสามารถในการหายใจลดลง
– มีอาการใจสั่น หัวใจเต้นเร็ว วิงเวียนศรีษะ และมีอาการเชื่องซึม
– หากสัมผัสกับผิวหนังจะทำให้เกิดผื่นแดง และอักเสบ
ผลแบบเรื้อรัง
– เกิดโรคในระบบทางเดินหายใจ เช่น โรคปอดอักเสบเรื้อรัง มีอาการหอบ ไอ
ผลกระทบต่อสิ่งแวดล้อม
ก๊าซซัลเฟอร์ไดออกไซด์ (SO2) เมื่ออยู่ในอากาศ และสัมผัสกับแสงแดด ภายในครึ่งวันหรือสองวันจะถูกออกซิไดซ์กลายเป็น SO3 เข้ารวมตัวกับความชื้นในอากาศ เช่น ไอน้ำ น้ำฝน กลายเป็นฝนกรดที่มี H2SO4 ในน้ำฝน
S (Fuel) + O2 → SO2
SO2 + 1/2 O2 → SO3
SO3 + H2O → H2SO4
วัสดุที่เป็นองค์ประกอบของหิน เช่น หินปูน และหินอ่อน สามารถดูดซับก๊าซซัลเฟอร์ไดออกไซด์ได้โดยตรง หลังจากนั้น จะถูกออกซิไดซ์เป็นซัลเฟต (SO4) ภายในหิน รวมตัวกับแคลเซียม (Ca) เป็นแคลเซียมซัลเฟต (CaSO4) ที่มีความหนาแน่นน้อยกว่าแคลเซียมคาร์บอเนต (CaCO3) แต่มีปริมาตรมากกว่าจนทำให้เกิดแรงดันจนเกิดเป็นรอยแตกของหิน นอกจากนั้น แคลเซียมซัลเฟต (CaSO4) สามารถละลายน้ำได้ดีกว่าแคลเซียมคาร์บอเนต (CaCO3) ทำให้หินละลายแตกตัวไปกับน้ำได้เร็วขึ้น
วัสดุอื่นๆ เช่น ไม้ เครื่องหนัง กระดาษ และอื่น เมื่อสัมผัสกับก๊าซซัลเฟอร์ไดออกไซด์ จะเกิดการผุกร่อน
มาตรฐานคุณภาพอากาศ
• ตลอดเวลา
– สหรัฐอเมริกา 0.03 ppm / 80 ไมโครกรัม/ลบ.ม.
– ไทย 0.1 ppm
• ตลอด 24 ชั่วโมง
– สหรัฐอเมริกา 0.14 ppm / 365 ไมโครกรัม/ลบ.ม.
– ไทย 0.3 ppm
การกำจัด
1. การออกซิไดซ์ SO2 เป็น SO3 ด้วยการเติมอากาศ
SO2(g) + 1/2 O2(g) → SO3(s)
2. ปฏิกิริยากับสารประกอบ
SO2(g)+ Ca(OH)2(aq) (น้ำปูนขาว) + H2O(l) +0.5O2 → CaSO4.H2O(g)
2CaCO3(s) + 2SO2(g) + O2(g) → CaSO4(s) + CO2(g)
MgO(s) + SO2(g) + 3H2O(l) → MgSO3.3H2O(s)
NaSO3(s) + SO2(g) + H2O(l) → 2NaHSO3(aq)

