กรดแลคติก (Lactic acid) เป็นกรดที่ผลิตได้จากกระบวนการสังเคราะห์ทางเคมีหรือการเมทาบอลิสซึมของจุลินทรีย์ มีลักษณะเป็นของเหลวไม่มีสี ละลายในน้ำ และตัวทำละลายได้ดี และสามารถตกผลึกได้หากมีความเข้มข้นสูง มักใช้มากในภาคอุตสาหกรรม
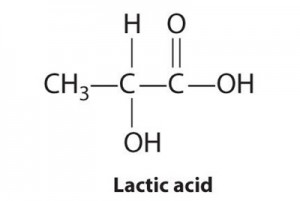
กรดแลคติก มีชื่อทางเคมี คือ 2-hydroxypropanoic acid มีสูตรโมเลกุล CH3CHOHCOOH แบ่งออกเป็น 3 ชนิด คือ
1. ชนิด L+ ผลิตได้จากการสังเคราะห์ จุลินทรีย์ และในร่างกายมนุษย์
2. ชนิด D- ผลิตได้จากการสังเคราะห์ และจุลินทรีย์
3. ชนิด DL ผลิตได้จากการสังเคราะห์ และจุลินทรีย์
กรดแลคติกที่ทำให้เกิดโรคเก๊าต์หรือข้ออักเสบในคนเราเกิดจากกรดแลคติกทั้ง3 ชนิด โดยชนิด L+ เป็นชนิดเดียวที่สามารเกิดขึ้นในร่างกายคนเราได้ และจะสะสมมากหากมีความปกพร่องของเอนไซม์ L- แลกเทตดีไฮโดรจีเนส ส่วนชนิด D- และDL ร่างกายคนเราจะได้รับ และสะสมจากการกินอาหารที่มีกรดจำพวกนี้อยู่มาก การสะสมของกรดแลตติกทั้ง 3 ชนิดนี้จึงเป็นสาเหตุของโรคในระบบข้อ กระดูก และกล้ามเนื้อตามมา
กรดแลคติกที่มีความบิสุทธิ์สูงจะสามารถเกิดผลึกได้ในแบบ monoclinic มีลักษณะเป็นผลึก ไม่มีสี ละลายน้ำได้ดี แต่ระเหยยาก
คุณสมบัติกรดแลคติก
1. มวลโมเลกุล 90.08
2. จุดหลอมเหลว
– ชนิด D-, L+ ในช่วง 52.8-54.0 องศาเซลเซียส
– DL ในช่วง 16.8-33.0 องศาเซลเซียส (ขึ้นอยู่กับอัตราส่วนผสม)
3. จุดเดือดในรูปการผสม D และ L ประมาณ 82.0 องศาเซลเซียส (0.5 มม. ปรอท)
4. ค่าคงที่การแตกตัว (Ka ที่ 25 องศาเซลเซียส) 1.37 x 10-4
5. ความร้อน 1361 KJ/mol
การนำไปใช้ ประโยชน์
1. อุตสาหกรรมอาหาร
อุตสาหกรรมอาหารถือเป็นอุตสาหกรรมที่นำกรดแลคติกมาใช้ประโยชน์มากที่สุด ซึ่งสามารถผลิตขึ้นได้เองหรือการเติมในกระบวนการหมักอาหารในอุตสาหกรรมหลายชนิด อาทิ นมเปรี้ยว โยเกิร์ต ขนมปัง เบียร์ เนยเทียม ผักผลไม้ดอง ไส้กรอก และเครื่องดื่มบางชนิด เป็นต้น นอกจากนั้นยังใช้เติมในอาหารเพื่อให้มีกลิ่น และรสเปรี้ยวที่น่ารับประทานหรือเพื่อป้องกันการเติบโตของเชื้อจุลินทรีย์อื่นที่ทำให้อาหารบูดเน่า และใช้กรดแลคติกผสมในเครื่องดื่มนิยมใช้ในรูปแคลเซียมแลคเตทเพื่อเสริมเกลือแร่ และแคลเซียม
สำหรับการถนอมอาหารอาจมีการใช้กรดแลคติกร่วมกับกรดอะซิติกสำหรับป้องกันการเติบโตของจุลินทรีย์ซึ่งจะทำให้มีประสิทธิภาพมากกว่าการใช้กรดแลคติกเพียงอย่างเดียว
นอกจากนี้ยังมีการใช้กรดแลคติกในรูปของเกลือสำหรับป้องกันการบูดเน่า เช่น โซเดียม และโพแทสเซียมแลคเตท ทำให้มีรสเค็มเล็กน้อย นิยมใช้ในอาหารประเภทเนื้อต่างๆ อาทิ เนื้อไก่ เนื้อปลา อาหารทะเล เป็นต้น
2. อุตสาหกรรมเครื่องสำอาง
– ผลิตภัณฑ์บำรุงผิว เช่น กรดแลคติก แลคเตท แคลเซียมแลคเตท โซเดียมแลคเตท เพื่อเป็นสารเร่งการผัดผิวใหม่ ให้ความชุ่มชื้น ลดการเกิดสิว ควบคุม pH
– ผลิตภัณฑ์สำหรับช่องปาก เช่น แคลเซียมแลคเตท เพื่อป้องกันฟันผุ และยับยั้งการก่อตัวของหินปูน ในรูปของส่วนผสมของยาสีฟัน และน้ำยาบ้วนปาก
– ผลิตภัณฑ์บำรุงเส้นผม โดยใช้กรดแลคติกเป็นส่วนผสมเพื่อทำหน้าที่เคลือบให้เส้นผมเงางาม
– ผลิตภัณฑ์ทำความสะอาดร่างกาย โดยใช้แคลเซียมแลคเตทเป็นส่วนผสมเพื่อทำหน้าที่ให้ความชุ่มชื้น และขัดเซลผิว อาทิ ครีมอาบน้ำ สบู่ก้อน สบู่เหลว โลชันทาผิว ยาสระผม และทำหน้าที่รักษาความชุ่มชื้นให้กับผลิตภัณฑ์
3. อุตสาหกรรมอื่นๆ
มีการใช้กรดแลคติกในอุตสาหกรรมด้านอื่นๆ ได้แก่
– การผลิตพลาสติกที่มีคุณสมบัติย่อยสลายได้ทางชีวภาพ เช่น การผลิตพลาสติกพอลิแลคเตท
– ใช้สำหรับปรับสภาพความเป็นกรด-ด่างของน้ำ ที่ใช้ในกระบวนการผลิตอุตสาหกรรมต่างๆ อาทิ อุตสาหกรรมพลาสติก อุตสาหกรรมผลิตเส้นใย อุตสาหกรรมยานยนต์ การผลิตเครื่องมือทางการแพทย์ เป็นต้น
– เป็นสารตั้งต้นผลิตสารอื่นๆ เช่น ผลิตกรดโพไพโนอิค กรดอะซิติค และกรดอะไซลิค เป็นต้น
– แอนติโมนีแลคเตท ใช้สำหรับเป็นส่วนผสมของสีย้อมทำให้สียึดติดแน่น
– แคลเซียมแลคเตท ใช้สำหรับกินเสริมป้องกันการขาดแคลเซียม
– คอปเปอร์แลคเตท ใช้เป็นส่วนผสมของน้ำยาชุบโลหะไฟฟ้า
– ไอออนแลคเตท ใช้สำหรับกินเสริมการขาดธาตุเหล็ก
– โซเดียมแลคเตท ใช้สำหรับเคลือบป้องกันความชื้น และการกัดกร่อนของวัสดุ
– เอทธิลแลคเตท ใช้สำหรับเป็นตัวทำละลายของไนโตเซลลูโลส และเซลลูโลสอะซิเตรท
– เอ็น บิวทิลแลคเตท ใช้เป็นตัวทำละลายของน้ำมันขัดเงา
– เมทธิลแลคเตท ใช้เป็นตัวทำละลายของเซลลูโลสอะซิเตรท
การผลิตกรดแลคติก
1. การสังเคราะห์ทางเคมี
ขั้นแรก ใช้กรด HCN ทำปฏิกิริยากับ acetaldehyde เป็น lactonitrille
HCN + CH3CHO = CH3CH(OH)CN
ขั้นสอง นำ lactonitrille มาทำปฏิกิริยาไฮโดรไลซิสกับ HCl จนได้กรดแลคติก เกลือแอมโมเนีย และสารประกอบอื่น
MeCH(OH)CN + H2O + HCl = MeCH(OH)COOH + NH4Cl
ขั้นสาม นำกรดแลคติกมาทำให้บริสุทธิ์ ด้วยการทำให้กลายเป็นอนุพันธ์เอสเทอร์ methyl lactate แล้วกลั่นเอาเอสเทอร์ออก ตามด้วยการทำ hydrolyzed methyl lactate จนกลายเป็นกรดแลคติกบริสุทธิ์ โดยระหว่างกระบวนการจะกำจัดเมธานอล HCN และสารอื่นออกด้วย
2. การใช้จุลินทรีย์
จุลินทรีย์ที่สามารถผลิตกรดแลคติกได้จะอยู่ในกลุ่ม แลคโตบาซิลลัส (Lactobacillus) ด้วยกระบวนการหมักน้ำตาลกลูโคสด้วยจุลินทรีย์ที่อุณหภูมิมากกว่า 40 องศาเซลเซียส ทำให้ได้ผลผลิต คือ กรดแลคติก เอธานอล กลีเซอรอล และก๊าซคาร์บอนไดออกไซด์
ปฏิกิริยาการหมักเพื่อให้เกิดกรดแลคติคแบ่งเป็น 2 ประเภท คือ
1. ปฏิกิริยาที่ทำให้เกิดแลคเตทเพียงอย่างเดียว เรียกว่า โฮโมเฟอร์เมนเททีฟ (Homofermentative)
2. ปฏิกิริยาที่ทำให้เกิดแลคเตทร่วมกับสารอื่น เรียกว่า เฮทเทอโรเฟอร์เมนเททีฟ (Heterofermentative)


